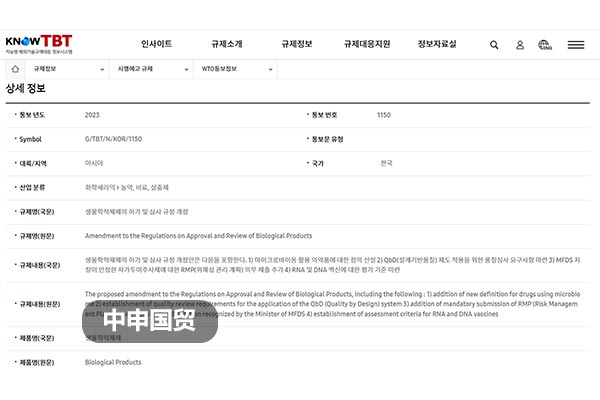
Южная Корея пересмотрела правила лицензирования и проверки биологических препаратов и других видов продукции.
Министерство по безопасности пищевых продуктов и лекарственных средств Республики Корея (MFDS) 26 июня 2023 года представило в ВТО уведомление под номером G/TBT/N/KOR/1150, в котором объявило о планах пересмотра ?Правил лицензирования и экспертизы биологических препаратов и других категорий? с целью усиления безопасности внутреннего рынка биологических препаратов. Изменения включают: определение терминов, таких как новые живые бактериальные препараты; требования к аудиту качества, применимые к системе проектирования качества; расширение сферы действия ?Индекса цитирования научных статей? для данных о фармакологическом действии и клинических испытаниях; изменение условий представления данных по испытаниям стабильности при изменении метода производства; добавление обязательной процедуры представления плана управления рисками для продуктов для самостоятельного введения, одобренных MFDS; а также установление стандартов оценки вакцин на основе РНК и ДНК. Учитывая, что Китай является вторым по величине рынком биологических препаратов в мире, данные изменения окажут значительное влияние на китайские компании-экспортеры. Предприятиям необходимо внимательно следить за этими изменениями и адаптироваться к ним.
商務(wù)部對(duì)歐盟乳制品發(fā)起反補(bǔ)貼調(diào)查.jpg)










 Номер разрешения на безопасность в сети Шанхая: 31011502009912.
Номер разрешения на безопасность в сети Шанхая: 31011502009912.



